Durant l’année 2020, nous avons vu que la Chine ne restait pas inactive, en dépit de l’impact de la pandémie de Covid-19, sur le front des évolutions réglementaires en matière de dispositifs médicaux.
Lancement d’une refonte de la réglementation
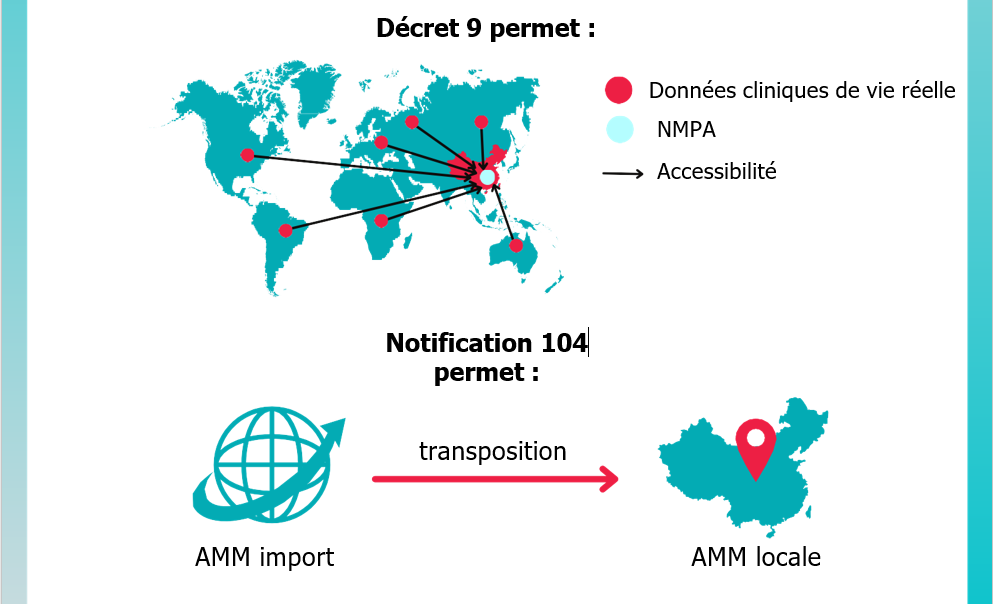
Après le Décret 9 de mars 2020, dont l’objet principal est d’étendre l’acceptabilité par la NMPA des données cliniques de vie réelle (Real World Evidence) collectées par les fabricants de dispositifs médicaux à l’international, et la Notification 104 de septembre 2020, qui facilite la transposition d’une AMM « import » vers une AMM « locale » lorsqu’un innovateur du DM présent sur le marché chinois décide de localiser tout ou partie de sa production ou de son assemblage. C’est à présent une refonte générale de la réglementation qui est lancée, à la suite de la publication du Décret d’État (State Council Decree) numéro 739, publié le 9 février 2021 et entré en vigueur le 1er juin dernier, signé par le Premier ministre LI Keqiang.
Des réglementations qui favorisent le « made in China for China »
Tout d’abord, sur le plan des dispositifs médicaux hors diagnostics in vitro, il vient renforcer les tendances à l’œuvre depuis quelques années visant à développer d’une part le « made in China for China » (facilitation des modalités de localisation de la production et de l’assemblage en Chine), d’autre part le « designed in China for China and the world » (facilitation des évolutions locales appliquées aux produits et services fondés sur l’innovation internationale).
Le texte vient traduire dans la réglementation la tendance de fond qui consiste, pour les distributeurs chinois de dispositifs médicaux en provenance de l’international, à développer certaines innovations visant à répondre aux besoins spécifiques des cliniciens et des patients chinois, par exemple en matière de connectivité, analyse des résultats, ou déploiement numérique.
En effet, il facilite l’acceptation rapide par la NMPA de ces évolutions, notamment à travers la confiance accrue qu’il accorde aux KOL cliniciens dans l’évaluation du rapport bénéfice-risque de ces innovations locales. Ainsi, la NMPA, dans le respect de ses obligations en matière de temps de réponse, fait de plus en plus appel aux experts du domaine – lesdits KOL – pour rester à la page et prendre des décisions éclairées vis-à-vis de produits et services friands de nouvelles technologies, elles-mêmes à l’intersection de plusieurs disciplines (science biomédicale, intelligence artificielle, Big Data, télémédecine, etc.)
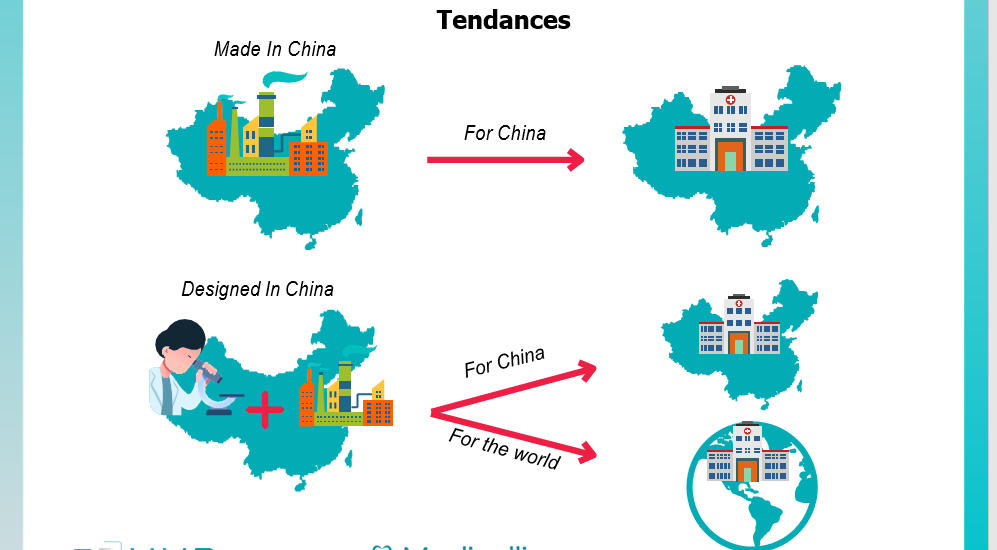
Les produits « évolution 2 » développés, dans certains cas, sont susceptibles de devenir les fers de lance de l’innovation mondiale ; l’objectif du pays est, dans l’étape suivante, de conquérir progressivement certains marchés internationaux avec ces produits. Pour les innovateurs occidentaux, il importe donc de parfaitement comprendre ces enjeux, et de sélectionner avec soin leur partenaire local, afin de profiter des nouvelles opportunités engendrées par cette stratégie tout en évitant le risque de se voir « tailler des croupières » par une nouvelle concurrence chinoise sur leurs marchés domestiques et traditionnels.
Des évolutions qui favorisent l’innovation en local
C’est sur le front des diagnostics in vitro que se situe l’évolution la plus marquante portée par le Décret d’État 739. Celui-ci institue en effet la possibilité, pour les grands hôpitaux publics accrédités, de
développer et utiliser eux-mêmes, sur leur propre patientèle (donc uniquement localement), de nouveaux outils de diagnostic, sans le préalable de l’enregistrement NMPA. Il s’agit, dans l’esprit, d’une transposition de pratiques à l’œuvre depuis de nombreuses années dans le domaine thérapeutique : en effet, les grands hôpitaux étaient depuis longtemps habilités à formuler et commercialiser leurs propres produits de médecine traditionnelle chinoise (TCM), sans devoir passer par la case NMPA.
Cette évolution, « ni vraiment LDT, ni vraiment CLIA », confirme toute la confiance que la Chine porte à ses cliniciens, et leur rôle central dans la politique de santé publique. Elle ouvre aux innovateurs du diagnostic in vitro d’immenses perspectives de retour sur investissement commercial rapide, pour peu qu’ils accomplissent les efforts nécessaires d’approche des KOL de leur domaine, afin de les motiver à entrer dans le cadre du Décret d’État 739 – plutôt que d’attendre le bon vouloir d’un partenaire de distribution ou une hypothétique levée de fonds locale pour procéder à l’enregistrement NMPA de leur produit (lequel, souvent en classe III, nécessitera vraisemblablement un essai clinique long et coûteux).
VVR Medical, de par sa capacité à aborder directement les KOL chinois les plus prestigieux dans tous les domaines thérapeutiques, et à accompagner ses clients sur le terrain dans la mobilisation concrète de ces KOL autour de leurs produits, est idéalement positionné pour accélérer l’entrée sur le marché chinois des dernières innovations en matière de diagnostics et de dispositifs médicaux innovants.






